
Grippe
Vaccin contre la grippe saisonnière : le point sur les effets indésirables
Le vaccin inactivé contre la grippe présente un très bon profil de sécurité.
Nous reprenons dans cet article les données actuelles disponibles sur les effets indésirables recensés du vaccin inactivé contre la grippe saisonnière. Rappelons que les vaccins commercialisés en Belgique ne comportent pas d’adjuvants et sont tous des vaccins trivalents. Un vaccin inactivé tétravalent est commercialisé dans certains pays. Le vaccin atténué contre la grippe saisonnière n’est pas encore disponible dans notre pays.
Comparaison des effets de l’infection et du vaccin
Le site de l’European Center for Disease prevention and control (ECDC) propose un tableau comparatif des risques liés à l’infection et à la vaccination par un vaccin inactivé contre la grippe saisonnière (1).
Nous en reprenons l’essentiel.
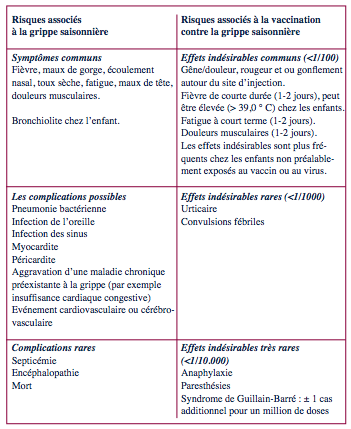
Les effets indésirables (2)
Effets indésirables couramment rencontrés
• Réactions locales au site d’injection :
douleur, oedème, rougeur, induration. Généralement de faible intensité, n’interférant pas avec les activités quotidiennes, d’une durée inférieure à 48 heures. Jusqu’à 65% (plus fréquentes avec les vaccins adjuvantés qu’avec les vaccins non adjuvantés).
• Réactions systémiques :
fièvre de courte durée (1–2 jour), myalgie, arthralgie, maux de tête. Moins de 15% ; plus fréquent chez les enfants et lors d’une première exposition aux antigènes du vaccin. Chez les jeunes enfants, les vaccins composés de subvirus donnent moins souvent des réactions systémiques.
• Ces effets systémiques n’ont plus été observé dans les essais récents des vaccins inactivés, la seule différence entre les groupes placebo et vaccinés étant une douleur au bras et une rougeur au site d’injection.
Effets indésirables rares (<1/10.000)
• Anaphylaxie
• Convulsions fébriles
Les études sur base des données disponibles ne confirment pas l’association entre l’administration du vaccin inactivé contre la grippe et les convulsions fébriles. Une association a été relevée en 2010 en Australie, mais elle était limitée aux enfants recevant le vaccin d’un producteur spécifique et n’a plus été retrouvée lors des saisons suivantes. Les enfants âgés de 12 à 23 mois qui reçoivent simultanément le vaccin conjugué 13 valent contre le pneumocoque et un vaccin inactivé contre la grippe ont un risque accru de convulsions fébriles (estimé à 1 pour 2.000 à 3.000 enfants vaccinés).
• Syndrome de Guillain-Barré
Le syndrome de Guillain-Barré survient avec une incidence annuelle de 10 à 20 cas par million d’adultes et est associé avec certaines infections respiratoires et gastro-intestinales (en particulier les infections à Campylobacter).
Le vaccin contre la grippe de 1976 a été associé à un risque accru de syndrome de Guillain-Barré (un peu moins de 10 cas pour 1 million de personnes vaccinées). Les études ultérieures n’ont montré aucun accroissement significatif du risque, ou une augmentation d’un cas additionnel pour 1 million de personnes vaccinées. Ce risque est significativement inférieur à celui d’une grippe sévère et à ses complications (3, 4).
• L’administration des vaccins contre la grippe saisonnière n’a jamais été associée à la narcolepsie.
Sécurité
Dans une étude incluant 250.000 enfants aux EU (5), aucune augmentation d’évènements médicaux n’a été relevée dans les 2 semaines suivant la vaccination avec un vaccin inactivé. Une étude incluant environ 45.000 enfants âgés de 6 à 23 mois (6) n’a pas montré d’association statistiquement significative avec des évènements médicaux, sauf une augmentation légère de gastrite et duodénite (se traduisant par des nausées et vomissements se résolvant spontanément) ; par ailleurs, une diminution des affections respiratoires supérieures, de l’asthme et de l’otite moyenne a été observée.
Les études sur base des données disponibles confirment un haut niveau de sécurité des vaccins inactivés chez la femme enceinte (7, 8).
Contre-indications et précautions
La vaccination contre la grippe à l’aide d’un vaccin inactivé est contre-indiquée chez les personnes présentant
- une réaction anaphylactique confirmée à une dose antérieure d’un vaccin contre la grippe
- une réaction anaphylactique confirmée à un composant du vaccin.
Références :
1 Influenza vaccination. European Center for disease prevention and control. http://www.ecdc.europa.eu/en/healthtopics/seasonal_influenza/vaccines/Pages/influenza_vaccination.aspx
2 Plotkin, Orenstein, Offit. Vaccines. 6th edition. Chapter 17.
3 Schessl J, Luther B, Kirschner J, Mauff G, Korinthenberg R. Infections and vaccinations preceding childhood Guillain-Barré syndrome : a prospective study. Eur J Pediatr 2006 ;165:605-612. http://www.ncbi.nlm.nih.gov/pubmed/16691408
4 R Baxter, N Bakshi, B Fireman et al. Lack of Association of Guillain-Barré Syndrome with Vaccinations. Clin Infect Dis. (2013) doi : 10.1093/cid/cit222. http://www.ncbi.nlm.nih.gov/pubmed/23580737
5 France E.K., Glanz J.M., Xu S., et al. Safety of the trivalent inactivated influenza vaccine among children : a populationbased study. Arch Pediatr Adolesc Med. 2004 ;158:1031-1036. http://www.ncbi.nlm.nih.gov/pubmed/15520339
6 Hambidge S.J., Glanz J.M., France E.K., et al. Safety of trivalent inactivated influenza vaccine in children 6 to 23 months old. JAMA. 2006 ; 296 (16):1990-1997. http://www.ncbi.nlm.nih.gov/pubmed/17062862
7 Mak T.K., Mangtani P., Leese J., et al. Influenza vaccination in pregnancy : current evidence and selected national policies. Lancet Infect Dis. 2008 ; 8:44- 52. http://www.ncbi.nlm.nih.gov/pubmed/18156088
8 Moro P.L., Broder K., Zheteyeva Y., et al. Adverse events in pregnant women following administration of trivalent inactivated influenza vaccine and live attenuated influenza vaccine in the Vaccine Adverse Event Reporting System, 1990-2009. Am J Obstet Gynecol. 2011 ; 205:473.e1-473. e9. http://www.ncbi.nlm.nih.gov/pubmed/20965490
Rechercher
Abonnez-vous à la newsletter
 Vax Info
Vax Info Grippe : avis du CSS pour la saison 2019-2020
Grippe : avis du CSS pour la saison 2019-2020