
Sécurité
Les vaccins  : contrôles approfondis
Contrairement aux autres médicaments, les vaccins sont contrôlés lot par lot indépendamment des producteurs. Ces contrôles sont obligatoires avant la libération de ces types de produits. Un fabricant doit avoir démontré l’efficacité, la sécurité et la qualité de la substance. Ensuite, il soumet chaque lot produit à l’autorité compétente pour contrôle. En Belgique, ces tâches sont effectuées par le service de Standardisation Biologique de l’Institut Scientifique de Santé Publique (WIV-ISP).
Les vaccins constituent un outil précieux pour la santé publique. Ils ont par exemple permis l’éradication de la variole et continuent à sauver d’innombrables vies. Ils provoquent toutefois une certaine appréhension chez une partie du public. Certains patients doutent en effet que les vaccins soient nécessaires, sûrs et efficaces.
Sentiment de méfiance
Ces sentiments proviennent d’un manque d’informations ou d’informations erronées. Cet article détaille la façon dont les vaccins sont contrôlés en Europe. Le processus reste peu connu malgré son haut niveau d’exigence. Il est toutefois essentiel que les patients puissent recevoir le meilleur éclairage possible à ce propos.
En effet, face à une hésitation à se faire vacciner, l’avis du corps médical a une influence positive sur la prise de vaccins à la fois chez l’enfant et chez l’adulte. Cet avis ne doit cependant pas nier ou minimiser les inconvénients mais doit les comparer aux avantages, bien supérieurs. Ces avantages sont individuels mais aussi sociétaux (épidémiologiques, économiques...) à condition que la couverture vaccinale reste suffisante. Les inconvénients, quant à eux, restent limités dans la plupart des cas (rougeur locale, légère fièvre...).
Il faut savoir qu’aucune étude scientifique ne lie les vaccins à l’apparition d’une maladie malgré ce que certains opposants prétendent (par ex. pour l’autisme). Le seul lien qui a été établi concerne le vaccin PandemrixTM contre la grippe H1N1 qui semble lié à une légère augmentation des risques de développer une narcolepsie (+3 à 7 cas sur 100.000 sujets vaccinés). La notice et les recommandations ont été adaptées en conséquence.
De même, les adjuvants, utilisés depuis longtemps, ne représentent pas de danger particulier. Il reste toutefois important de mentionner que les vaccins provoquent une réaction locale et qu’ils n’assurent pas une protection à 100%.
Principe des évaluations et des contrôles
En Europe, avant de pouvoir vendre un nouveau vaccin, le producteur doit d’abord l’enregistrer, c’est à dire obtenir une autorisation de mise sur le marché des autorités compétentes, à savoir la Commission Européenne, après avis positif de l’Agence Européenne des Médicaments (EMA), basée à Londres, ou, s’il s’agit d’un médicament destiné à la Belgique, du Ministre de la Santé Publique sur avis de la Commission des Médicaments. Ces instances se basent sur le dossier établi par le fabricant.
Ce dossier détaille la composition du produit, les analyses réalisées et les résultats des essais cliniques.
Le producteur a ensuite l’obligation supplémentaire de demander pour chaque lot produit un certificat de conformité au laboratoire officiel de contrôle des médicaments (ou OMCL) d’un pays européen de son choix, avant l’utilisation ou la mise sur le marché du lot concerné. Aucun lot de vaccin à usage humain n’est libéré en Europe si sa qualité n’a pas été démontrée et confirmée. En Belgique, c’est le laboratoire de Standardisation Biologique de l’Institut Scientifique de Santé Publique (WIV-ISP) qui se charge de cette tâche. Cette unité est constituée de 10 scientifiques et de 20 techniciens.
Ces contrôles de qualité se font dans le cadre du réseau européen des OMCLs coordonné par la Direction européenne de la Qualité des Médicaments (EDQM), sous l’égide du Conseil de l’Europe. La libération des lots de vaccins humains est une activité effectuée indépendamment du producteur, même si celui-ci a déjà réalisé tous les tests requis par les normes en vigueur. Ces normes correspondent entre autres aux recommandations de l’Organisation Mondiale de la Santé (OMS) et à la Pharmacopée Européenne (Ph.Eur.), outil d’harmonisation de la qualité des médicaments. Lors de la rédaction des procédures spécifiques par produit, les représentants des OMCLs définissent par consensus quels tests doivent être effectués par le laboratoire de contrôle et sur quels échantillons, ainsi que les informations minimales que le producteur doit soumettre.
En pratique, la libération d’un lot consiste à vérifier sa conformité avec ces normes internationales et le dossier d’enregistrement, d’une part par l’évaluation des protocoles de production et de contrôle du fabricant, et d’autre part, par des analyses d’un laboratoire officiel. Ces tests impliquent la mise en œuvre de méthodes analytiques adaptées et validées.
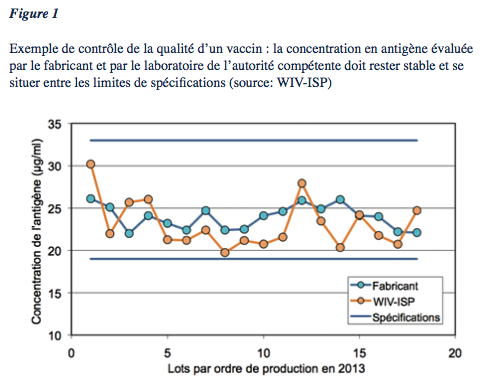
Pour les vaccins, il s’agit principalement de l’apparence, la description (couleur du produit), l’identité, l’activité virale des vaccins viraux atténués (par ex. la rougeole), l’activité de vaccins bactériens (ex. diphtérie, tétanos, coqueluche), la pureté, le contenu en polysaccharide (ex. Haemophilus influenzae b)... Un exemple de test de contrôle d’un vaccin sur un an est donné dans la figure 1.
Réseau européen
En Europe, la libération de lots se fait selon le principe de reconnaissance mutuelle, ce qui signifie qu’un lot sera contrôlé par un seul OMCL, même si un producteur de médicaments biologiques vend un lot dans plusieurs pays européens. Ces pays reconnaissent le certificat de conformité délivré par le laboratoire ayant testé le lot.
Il faut savoir qu’aucune étude scientifique ne lie les vaccins à l’apparition d’une maladie malgré ce que certains opposants prétendent (par ex. pour l’autisme). Le seul lien qui a été établi concerne le vaccin PandemrixTM contre la grippe H1N1 qui semble lié à une légère augmentation des risques de développer une narcolepsie (+3 à 7 cas sur 100.000 sujets vaccinés ). La notice et les recommandations ont été adaptées en conséquence.
Ceci implique de produire des résultats d’analyses fiables et reproductibles au sein d’un contrôle de qualité robuste. C’est la raison pour laquelle les OMCL utilisent des méthodes accréditées selon une norme internationale de qualité (ISO 17025). Les résultats des tests réalisés ainsi que le suivi par chaque laboratoire des données critiques soumises par le producteur permettent d’évaluer la régularité et la stabilité de la production au cours du temps pour les médicaments biologiques contrôlés. Il arrive qu’un certificat de non-conformité soit délivré si les résultats de tests sont déclarés non conformes par rapport aux normes en vigueur. Le réseau des laboratoires est alors informé via un système d’information rapide et le lot ne pourra pas être vendu par le producteur. En Europe, cela reste un événement rare vu le niveau de maîtrise des contrôles de la qualité lors de la production de vaccins. En Europe en 2013, trois lots ont été rejetés sur 3.914 testés. La Belgique a réalisé plus de 30% de ces tests (1.249 lots) et a rejeté un lot.
Ces normes d’analyses précises et comparables internationalement impliquent la participation active à des programmes de standardisation biologique. Ces études collaboratives en aveugle sont organisées par l’EDQM ou l’OMS dans le but soit de standardiser une méthode analytique (par ex. une méthode commune pour le contrôle du vaccin poliomyélitique inactivé), soit d’établir une nouvelle référence biologique au niveau européen ou un standard international. Dans l’optique d’une standardisation internationale, les OMCL échangent leurs informations avec les autres laboratoires du réseau. En outre, chaque OMCL rédige annuellement un rapport. Tous les laboratoires se réunissent par la suite afin de faciliter et de développer les échanges. A notre demande, l’OMCL belge organisera la rencontre de 2015 à Bruxelles. Ces échanges en toute transparence sont essentiels. En effet, le domaine est en constante évolution vu d’une part le développement de nouveaux vaccins (par ex. contre la malaria, le VIH, l’hépatite C...) et d’autre part l’amélioration continue des techniques et la validation de nouvelles méthodes analytiques.
Actions en amont
A côté de ces tâches de contrôle, le service de Standardisation Biologique participe aux inspections de Bonnes Pratiques de Fabrication (GMP) sur les sites de production de vaccins. A la demande de l’Agence Fédérale des Médicaments et Produits de Santé (AFMPS), le service réalise également l’évaluation de la partie qualité des dossiers d’enregistrement de vaccins et des dossiers de demandes pour essais cliniques à réaliser en Belgique.
Le dossier d’enregistrement englobe les détails du processus de fabrication du produit. Si par la suite le producteur effectue des changements à ce processus, il doit établir un dossier de variation qui compare les données des anciens et des nouveaux lots (par ex. si une étape clé du processus a été modifiée ou si l’échelle de production a été augmen- tée). En Europe, l’évaluation critique de ces dossiers est demandée conjointement à deux pays. Ceux-ci produisent un rapport qui circule dans l’ensemble des pays concernés. Ces derniers peuvent poser des questions auxquelles le producteur a l’obligation de répondre.
Le rôle du laboratoire belge est donc d’agir à la demande de l’AFMPS en tant qu’expert pour le respect des normes de qualité des dossiers qui ont trait aux vaccins.
Le service a développé un savoir-faire et une expertise de haut niveau dans
le domaine des vaccins, grâce à la connaissance du cycle de vie complet de ces produits – de l’enregistrement au contrôle de qualité après la mise sur le marché, en passant par les inspections, tant au niveau national qu’international –. Cette expertise est valorisée par la participation à différents groupes d’avis et de rédaction de textes réglementaires en la matière. Cela concerne entre autres les monographies Ph.Eur., les guidances de libération de lots (OCABR) et la préqualification des vaccins par l’OMS pour garantir à l’UNICEF d’acheter des vaccins de qualité assurée.
Conclusion
Il faut retenir que les vaccins sont des substances très bien caractérisées et extrêmement contrôlées. Les craintes liées aux effets indésirables ou à des contaminations ne sont donc pas fondées.
Monde : www.who.int/vaccine_safety
Europe : www.edqm.eu et www.ema.europa.eu
Belgique : www.fagg-afmps.be et www.wiv-isp.be
Informations sur la perception des vaccins par le public : www.vaccineconfidence.org
AFMPS : Agence Fédérale des Médicaments et Produits de Santé EDQM : European Directorate for the Quality of Medicines & Health-Care (Strasbourg, France)
EMA : European Medicines Agency (Londres, Royaume-Uni)
GMP : Good Manufacturing Practices
OCABR : Official Control Authority Batch Release for Human Biological Medicines (pour la libération des lots en Europe)
OMCL : Official Medicines Control Laboratories (laboratoires officiels de contrôle des médicaments) Ph.Eur. : Pharmacopée Européenne WIV-ISP : Institut Scientifique de Santé Publique (belge)
Dr Koen Brusselmans, évaluateur scientifique
Lorenzo Tesolin, responsable du contrôle de vaccin
Geneviève Waeterloos,
chef de service Laboratorium Biologische Standaardisatie WIV-ISP
Toute demande d’information supplémentaire peut être adressée à Geneviève Waeterloos, chef de service (genevieve.waeterloos wiv-isp.be).
Références :
- Gargano LM, Herbert NL, Painter JE, Sales JM, Morfaw C, Rask K, Murray D, DiClemente RJ, Hughes JM. Impact of a physician recommendation and parental immunization attitudes on receipt or intention to receive adolescent vaccines. Human Vaccines & Immunotherapeutics 2013, 9:2627- 33, http://dx.doi.org/10.4161/hv.25823
– Nohynek H, Jokinen J, Partinen M, Vaarala O, Kirjavainen T, Sundman J, Himanen SL, Hublin C, Julkunen I, Olsén P, Saarenpää-Heikkilä O, Kilpi T. AS03 Adjuvanted AH1N1 Vaccine Associated with an Abrupt Increase in the Incidence of Childhood Narcolepsy in Finland. Plos One, March 28, 2012, http://dx.doi.org/10.1371/journal.pone.0033536
– Par exemple le squalène : http://www.who.int/vaccine_safety/committee/topics/adjuvants/squalene/questions_and_answers/fr/
Et l’aluminium : Vaxinfo de mai 2014 : http://www.vaxinfopro.be/spip.php?article1060&lang=fr&retour=1
Rechercher
Abonnez-vous à la newsletter
 Vax Info
Vax Info Qu’y a-t-il dans un vaccin ?
Qu’y a-t-il dans un vaccin ?