
Veiligheid vaccins
Verregaande controle
Anders dan gewone medicamenten worden vaccins lot per lot gecontroleerd voor ze op de markt worden gebracht en dit onafhankelijk van de producent. De fabrikant moet de werkzaamheid, de veiligheid en de kwaliteit van het product aantonen. Vervolgens moet elk lot ter controle voorgelegd worden aan een onafhankelijk laboratorium hiertoe aangeduid door de overheid. In België gebeurt die controle door de dienst Biologische Standaardisatie van het Wetenschappelijk Instituut Volksgezondheid (WIV-ISP).
Vaccins zijn belangrijk voor de volksgezondheid. Dank zij vaccins zijn bepaalde ziekten zoals de pokken uitgeroeid en worden elke dag vele levens gered. Toch roepen ze bij sommige mensen ook wantrouwen en afkeer op. Zijn vaccins wel nodig? Efficiënt? Veilig?
Dat heeft te maken met een gebrek aan informatie of aan verkeerde informatie. In dit artikel beschrijven we de strenge controles die in Europa worden uitgevoerd op vaccins. Het is belangrijk dat artsen en patiënten op dit punt correct en volledig worden geïnformeerd.
Wantrouwen
Verschillende studies hebben aangetoond dat de houding van de arts tegenover vaccinatie zeer belangrijk is om mensen die twijfelen om zichzelf of hun kinderen te laten vaccineren, toch te overtuigen(1). De arts moet de mogelijke nadelen niet ontkennen of minimaliseren, maar moet ze afwegen tegen de voordelen die veel groter zijn. Deze voordelen betreffen niet alleen het individu dat gevaccineerd wordt, maar ook de maatschappij (epidemiologisch, economisch...), op voorwaarde dat een voldoende hoge vaccinatiegraad wordt bereikt. De nadelen zijn meestal zeer beperkt en verwaarloosbaar en doorgaans van voorbijgaande aard: lokale uitslag en/of pijn, lichte koorts...
Tot nu toe heeft geen enkele wetenschappelijke studie een verband kunnen aantonen tussen vaccins en bepaalde ziekten zoals autisme, ook al wordt vaak het tegendeel beweerd. Alleen voor het endemische H1N1 griepvaccin Pandemrix bestaan er aanwijzingen voor een licht verhoogde kans op narcolepsie (+3 à 7 gevallen per 100.000 gevaccineerden) (2). De bijsluiter en de aanbevelingen werden dan ook aangepast.
Ook de adjuvantia die al sinds lang gebruikt worden in vaccins, zijn veilig (3). Toch is het belangrijk om weten dat vaccins lokale reacties kunnen veroorzaken en geen 100% bescherming bieden.
Evaluatie en controle
Vooraleer een vaccin in Europa mag verkocht worden, moet het geregistreerd worden en van de Europese Commissie een vergunning krijgen om het op de markt te brengen, na advies van het Europees Geneesmiddelenagentschap (EMA). Voor een geneesmiddel dat alleen voor de Belgische markt is bedoeld, gebeurt die goedkeuring door het Ministerie van Volksgezondheid na advies van de Geneesmiddelencommissie. Deze instanties baseren zich daarbij op een wetenschappelijk dossier van de producent. Dat dossier bevat een gedetailleerde beschrijving van de samenstelling van het product, de testresultaten van de uitgevoerde analyses en de bevindingen van de klinische testen. Voor vaccins moet de producent bovendien voor elk lot een conformiteitsattest aanvragen bij een officieel laboratorium voor de controle van geneesmiddelen (Official Medicines Control Laborato- ries, OMCL) in een Europees land van zijn keuze, vooraleer het lot op de markt mag worden gebracht. Een lot mag niet vrijgegeven worden indien de kwaliteit van de vaccins niet is gecontroleerd en bevestigd. In België is het laboratorium voor Biologische Standaardisatie van het Wetenschappelijk Instituut Volksgezondheid (WIV-ISP) verantwoordelijk voor deze taak. Deze dienst bestaat uit 10 wetenschappers en 20 laboratoriumtechnologen.
Deze kwaliteitscontroles gebeuren in het kader van een Europees netwerk van OMCL’s dat gecoördineerd wordt door het Europees Directoraat voor de Kwaliteit van Geneesmiddelen (EDQM) van de Raad van Europa. De controles gebeuren onafhankelijk van de producent, zelfs indien deze alle vereiste controles al heeft laten uitvoeren. De gebruikte normen komen overeen met die van de Wereldgezondheidsorganisatie (WHO) en de Europese Farmacopee (Ph.Eur.), een instrument voor de harmonisatie van kwaliteitsnormen voor geneesmiddelen.
De specifieke procedures voor elk product worden in consensus vastgelegd door de OMCL’s, waarbij wordt bepaald welke testen op welke stalen moeten worden uitgevoerd, en welke minimale informatie de producent moet voorleggen.
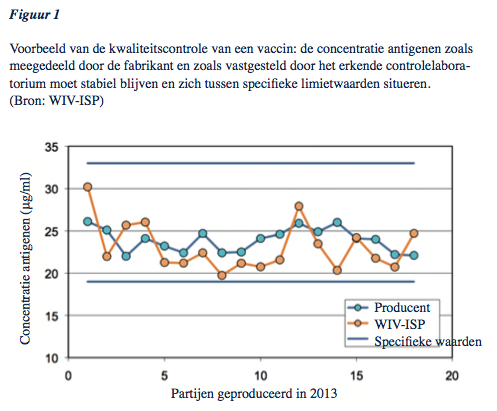
In de praktijk wordt elk lot vaccins gecontroleerd op conformiteit met de internationale normen en het registratiedossier. Naast een analyse van de productieprotocollen en de controles van de fabrikant, gebeuren ook testen door middel van aangepaste en gevalideerde methoden in een officieel laboratorium. Voor vaccins wordt daarbij ondermeer het uitzicht van het geneesmiddel (kleur) geverifieerd evenals de identiteit, de werkzaamheid van afgezwakte virale vaccins (bv. mazelen) en van bacteriële vaccins (bv. difterie, tetanus, kinkhoest), de zuiverheid, de hoeveelheid polysacchariden (bv. Haemophilus influenzae b)... Figuur 1 geeft een voorbeeld van een controle-test op alle loten van een bepaald vaccin gedurende één jaar.
Europees Netwerk
In Europa gebeurt de goedkeuring van vaccinloten volgens het principe van de wederzijdse erkenning : dat betekent dat elk lot door slechts één OMCL wordt gecontroleerd, zelfs indien dit lot in meerdere Europese landen op de markt wordt gebracht. Elk land erkent dus het conformiteitsattest dat wordt afgeleverd door het laboratorium dat de testen uitvoerde.
Dat vereist dat de testen worden uitgevoerd in een kwaliteitszorgsysteem (ISO 17025) met aangepaste en gevalideerde methoden. De aldus uitgevoerde testen vormen, samen met een analyse van de data die door de producent worden voorgelegd, een garantie voor de regelmatigheid en de stabiliteit van de gecontroleerde vaccins.
Wanneer de testresultaten niet conform de vastgelegde normen zijn, dan wordt een certificaat van niet-conformiteit afgeleverd. Het Europees netwerk van laboratoria wordt dan verwittigd via een alarmsysteem en het desbetreffende lot mag in Europa niet op de markt worden gebracht. Dat gebeurt slechts uitzonderlijk. In 2013 werden slechts 3 van de 3.914 geteste loten afgekeurd. 30% van deze tests (1.249 loten) werden in België uitgevoerd, waarbij één lot werd tegengehouden.
Het opstellen van precieze en internationaal vergelijkbare kwaliteitsnormen vereist uiteraard internationale samen- werkingsprogramma’s over biologische standaardisatie. Deze studies worden georganiseerd door het EDQM en de WHO, met als doel gestandardiseerde analysemethoden op te stellen (bv. voor de controle van het geïnactiveerde poliovaccin) of om nieuwe Europese biologische referenties of internationale standaarden vast te leggen.
De OMCL’s uit het netwerk wisselen onderling informatie uit, publiceren jaarverslagen en komen geregeld samen om hun resultaten te bespreken. In 2015 zal deze samenkomst doorgaan in België. Dergelijke bijeenkomsten zijn belangrijk omdat de wereld van de vac- cins snel verandert door de komst van nieuwe vaccins (bv. tegen malaria, HIV, hepatitis C...) en door de voortdurende verbetering van technieken en de validatie van nieuwe analysemethoden.
Andere activiteiten
Naast haar controletaken werkt de dienst Biologische Standaardisatie op vraag van het het Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten (FAGG) ook mee aan de inspecties van de ‘Good Manufacturing Practices’ (GMP) op de productiesites van vaccins, aan de evaluatie van de kwaliteitsgegevens van registratiedossiers van vaccins en van aanvraagdossiers voor klinische proeven met vaccins in België.
Het registratiedossier van een vaccin bevat gedetailleerde gegevens over het productieproces. Indien dat proces later wordt gewijzigd, dan moet de producent een nieuw dossier indienen waarin de verschillen tussen oude en nieuwe partijen worden beschreven (bv. indien een belangrijke stap in het productieproces wordt veranderd of wanneer de productieschaal wordt verhoogd). In Europa gebeurt de analyse van deze dossiers tegelijk in twee landen. Hun rapporten worden aan alle betrokken landen overgemaakt, en elk land kan bijkomende vragen stellen waarop de producent moet antwoorden. De dienst Biologische Standaardisatie treedt op vraag van het FAGG op als expert voor de evaluatie van de kwaliteitsgegevens van de registratie- en variatie-dossiers voor vaccins.
De dienst heeft op dit vlak een grote expertise opgebouwd omdat ze de hele levenscyclus van vaccins opvolgt, van de erkenning over de kwaliteitscontrole na de commercialisatie tot nationale en internationale controles. De Dienst is dan ook betrokken bij diverse nationale en internationale adviesorganen en bij het opstellen van wetenschappelijke adviezen en reglementaire teksten. Dit betreft onder meer de Europese Farmacopee, de audits georganiseerd door het EDQM, de controles in het kader van de toelating van vaccins (OCABR) en de prekwalificatieprocedure van de WHO van de vaccins bestemd voor UNICEF.
Besluit
Vaccins worden in Europa zeer streng gecontroleerd. De vrees voor ongewenste effecten of contaminatie van vaccins is dan ook ongegrond.
– www.who.int/vaccine_safety
– www.edqm.eu en www.ema.europa.eu
– www.fagg-afmps.be en www.wiv-isp.be
Info over de perceptie van vaccins door het grote publiek : www.vaccineconfidence.org
EDQM : European Directorate for the Quality of Medicines & Health-Care (Straatsburg, Frankrijk)
EMA : European Medicines Agency (Londen, UK)
FAGG: Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
GMP: Good Manufacturing Practices OCABR : Official Control Authority Batch Release for Human Biological Medicines
OMCL: Official Medicines Control Laboratories
Ph.Eur.: Europese Farmacopee WIV-ISP : Wetenschappelijk Instituut Volksgezondheid
onderzoekscoördinator
Dr Koen Brusselmans,
wetenschappelijk medewerker
Lorenzo Tesolin,
verantwoordelijke vaccincontrole
Geneviève Waeterloos,
diensthoofd Laboratorium Biologische Standaardisatie WIV-ISP
Voor bijkomende informatie kunt u zich wenden tot : Geneviève Waeterloos, diensthoofd (genevieve.waeterloos@ wiv-isp.be).
Referenties:
1. Gargano LM, Herbert NL, Painter JE, Sales JM, Morfaw C, Rask K, Murray D, DiClemente RJ, Hughes JM. Impact of a physician recommendation and parental immunization attitudes on receipt or intention to receive adolescent vaccines. Human Vaccines & Immunotherapeutics 2013, 9:2627-33, http://dx.doi.org/10.4161/hv.25823
2. Nohynek H, Jokinen J, Partinen M, Vaarala O, Kirjavainen T, Sundman J, Himanen SL, Hublin C, Julkunen I, Olsén P, Saarenpää-Heikkilä O, Kilpi T. AS03 Adjuvanted AH1N1 Vaccine Associated with an Abrupt Increase in the Incidence of Childhood Narcolepsy in Finland. Plos One, March 28, 2012, http://dx.doi.org/10.1371/journal.pone.0033536
3. Bv squaleen : Vax Info van december 2010 http://www.vaxinfopro.be/spip.php?article125&lang=nl&retour=1
En aluminium : Vax Info van mei 2014 : http://www.vaxinfopro.be/spip.php?rubrique51&lang=nl&retour=1
 Vax Info
Vax Info Wat zit er in een vaccin?
Wat zit er in een vaccin?