
Grippe
A la recherche de vaccins plus protecteurs
Les vaccins contre la grippe les plus utilisés sont les vaccins trivalents inactivés (split ou subunit). Ces vaccins offrent une protection adéquate aux enfants et aux adultes. Cependant, il y a un besoin de vaccins plus immunogènes pour la vaccination des personnes âgées (≥ 65 ans) et des personnes fragilisées (affections chroniques du cœur, des poumons, etc ; diabète ; immunodéficience...). L’adjonction d’adjuvants (émulsion huile/eau) ou l’injection intradermique accroissent la réponse immunologique au vaccin contre la grippe. Pour les jeunes enfants, les vaccins vivants atténués permettent une meilleure stimulation initiale du système immunitaire.
La stratégie la plus efficace pour prévenir la grippe est la vaccination annuelle. La vaccination est recommandée depuis de nombreuses années aux personnes ayant un risque accru de complications graves suite à une grippe et il existe, à l’échelle internationale, une tendance à élargir les indications de la vaccination contre cette infection. Ainsi, depuis 2010 aux Etats-Unis, la vaccination annuelle contre la grippe est recommandée pour toutes les personnes âgées de plus de 6 mois (Fiore, 2010).
Variabilité antigénique du virus de la grippe
Un obstacle important et persistant pour la production de vaccins contre la grippe est la variabilité antigénique du virus. Pour répondre à cette exigence, des représentants du Global Influenza Surveillance and Response System (GISRS) de l’Organisation mondiale de la santé (OMS) se réunissent deux fois par an, pour examiner la composition du vaccin saisonnier pour les hémisphères nord et sud, et si nécessaire l’adapter. Les souches de virus de grippe qui seront inclues dans le futur vaccin saisonnier sont sélectionnées sur base des données de surveillance les plus récentes du GISRS.
En février 2012, la composition du vaccin contre la grippe pour la saison hivernale 2012-2013 (hémisphère nord) a été établie comme suit : une souche A/ California/7/2009 (H1N1)pdm09-like virus, une souche A/Victoria/361/2011 (H3N2)-like virus et une souche B/Wisconsin/1/2010-like virus (de la lignée B/Yamagata).
Pour produire les vaccins contre la grippe en temps utile, la sélection des souches vaccinales débute habituellement 9 à 12 mois avant le commencement de la saison de grippe. Durant ce laps de temps, un nouveau variant né d’un drift peut encore apparaître, ce qui explique que les souches comprises dans le vaccin puissent encore différer des souches de virus circulant. Cette inadéquation pourra conduire à une efficacité limitée du vaccin.
Durant les 31 périodes annuelles de grippe saisonnière, de 1980-1981 à 2011-2012, la composition du vaccin a été modifiée à 11 reprises pour la composante A/H1N1, 19 fois pour la composante A/H3N2 et 15 fois pour la composante B.
Les épidémies annuelles de grippe sont causées chez l’homme par les virus Influenza A et B.
Le matériel génétique des virus de la grippe comporte 8 segments d’ARN séparés qui codent 11 protéines déterminant la structure et la réplication du virus. Les deux protéines de surface hémagglutinine (HA) et neuraminidase (NA) sont les cibles principales de l’immunité protectrice humorale. Les protéines de matrice M12 et M2 sont présentes plus en profondeur, de même que la nucléoprotéine (NP) qui entoure les sergments d’ARN.
Les virus de la grippe sont classés en sous-types sur base des antigènes de surface les plus importants, HA et NA. Depuis 1977, deux sous-types de virus A circulent chez l’homme : A/H1N1 en A/H3N2.
Deux lignées génétiques différentes de virus B de la grippe induisent des pathologies humaines, en particulier les lignées Yamagata et Victoria.
De nouveaux variants du virus A naissent sur base de drift et de shift antigéniques. Un drift antigénique est le résultat de mutations ponctuelles et de recombinaisons qui surviennent durant la réplication virale. Ce phénomène est à la base des changements qui rendent régulièrement nécessaires les adaptations des vaccins contre la grippe saisonnière.
Le shift antigénique est un phénomène très radical qui peut mener à une pandémie de grippe. Un shift survient lorsque deux virus de grippe différents infectent une même cellule et y réarrangent (réassortiment) leur matériel génétique (8 segments de gènes). De cette manière, un virus de grippe saisonnière peut acquérir soudainement l’hémaglutinine, la neuraminidase (et éventuellement encore d’autres gènes) d’un virus aviaire hautement pathogène. Le virus de la grippe pandémique 2009 (Influenza A/H1N1pdm09) comporte une combinaison de gènes qui étaient trouvés précédemment chez l’homme, le porc et les oiseaux.
Les vaccins contre la grippe saisonnière
Les vaccins trivalents inactivés (TIV)
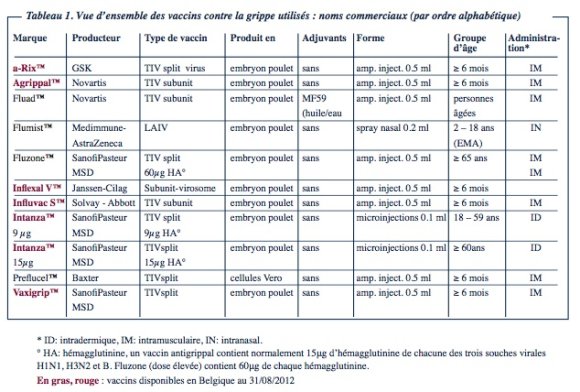
La plupart des vaccins contre la grippe saisonnières sont des vaccins trivalents inactivés (trivalent inactived vaccines, TIV). Ils contiennent 15 μg de chacune des souches de virus incorporées au vaccin (en 2012, A/H1N1, A/H3N2 et B).
Les virus de la grippe qui sont traités dans les vaccins saisonniers sont cultivés sur des œufs de poule embryonnés. Un œuf produit le matériel pour environ une dose de vaccin avec environ 15 μg de HA de chacune des trois souches virales sélectionnées (A/H1N1, A/H3N2 et B).
Les souches de culture du virus Influenza B sont habituellement préparées sur base des isolats de terrain qui poussent bien dans des œufs de poule embryonnés. Etant donné que la plupart des souches naturelles de virus influenza A ne se reproduisent pas en œufs de poule, elles ne sont pas adaptées à la production de vaccins. Pour cette raison, les segments d’ARN codant pour l’HA et la NA du virus sauvage sont combinés avec les 6 segments restant d’ARN d’une souche virale de laboratoire qui pousse bien sur embryon de poulets (virus influenza A PR8). La création de cette souche vaccinale est réalisée dans des laboratoires spécialisés, au New York Medical College, au National Institute for Biological Standards and Control (NIBSC-UK) et chez le producteur de vaccin CSL en Australie.
Les virus de la grippe isolés à partir des cultures sont dans un premier temps inactivés chimiquement et fragmentés par un traitement au détergent. Selon le degré de purification des fragments, on parle de vaccins « split » ou « subunit ».
Le vaccin subunit est le produit le plus pur et ne contient presque uniquement que des molécules HA et un peu de NA.
Le vaccin split contient par contre, outre le HA et le NA également des protéines de la matrice et des nucléoprotéines. Il est exigé, tant des vaccins split que subunit, qu’ils contiennent par dose vaccinale 15 μg de chacune des souches vaccinales sélectionnées.
Un vaccin à virus entier (whole virus) est obtenu lorsque le virus inactivé est gardé intact et non fragmenté. Les vaccins contre la grippe à virus entier ont été les premiers utilisés. Ils étaient très immunogènes et efficaces, mais ils ont été remplacés par les vaccins plus purifiés subunit et split, en raison de leur réactogénicité (induction d’effets indésirables, principalement chez l’enfant).
Des vaccins à virus entier sont encore produits et utilisés dans certains pays (entre autres la Russie). Des vaccins à virus entier ont aussi été utilisés dans la lutte contre des virus de grippe pandémique (H5N1 et H1N1pdm09).
Tous ces vaccins contiennent du virus de la grippe tué (inactivé, entier ou fragmenté) et ne peuvent donc jamais occasionner une infection. Dans certains cas, ils induisent une fièvre modérée ou des courbatures qui sont interprétées à tort comme des signes de grippe. En outre, le vaccin contre la grippe protège uniquement contre la grippe et les personnes vaccinées restent toujours susceptibles de contracter des infections par d’autres pathogènes respiratoires (rhinovirus, adénovirus, RSV, métapneumovirus humain, etc). Ces infections sont souvent considérées par les patients comme une grippe, ce qui réduit de manière injuste la confiance dans les vaccins contre la grippe.
Les vaccins vivants atténués (LAIV)
Un vaccin contre la grippe vivant atténué existe également. Ce live attenuated Influenza Virus (LAIV) est utilisé depuis 2003 aux Etats-Unis pour la vaccination des personnes âgées de 2 à 49 ans. L’Agence Européenne de Médicament (EMA) a approuvé ce vaccin pour les personnes âgées de 2 à 18 ans. Il est administré en intranasal via un spray.
Ces virus vivants atténués sont produits en réassortissant chaque souche virale sélectionnée par l’OMS avec une souche virale particulière (cold-adapted Influenza A/Ann Arbor/6/1960) qui se réplique dans le nasopharynx à 25°C, mais pas à une température plus élevée dans les voies aériennes profondes.
Ce vaccin peut, contrairement aux vaccins inactivés, provoquer une légère grippe (fièvre modérée, écoulement et congestion nasals, maux de tête).
Procédés de production
Malgré la longueur du processus de production (jusqu’à 8 mois), l’industrie doit encore toujours s’appuyer sur la culture sur œufs de poule.
Depuis un certain temps, les virus de la grippe sont aussi produits sur des cultures de cellules. La société la plus avancée dans cette matière est Baxter, mais d’autres producteurs (comme Novartis, SanofiPasteur MSD, GSK, etc.) explorent cette technologie. Les avantages de la production sur culture de cellules sont l’indépendance vis-à-vis du stock et de la production d’œufs de poule embryonnés, la possibilité de pouvoir utiliser directement des souches de virus sauvages à la place de réassortants qui poussent sur œufs, le risque plus limité de contamination bactérienne, le raccourcissement du processus de production à ± 10 semaines, la suppression du risque d’allergie aux protéines de l’œuf.
Adjuvants
Les vaccins contre la grippe saisonnière ne contiennent pas d’adjuvants puisqu’on sait depuis longtemps que l’adjonction des adjuvants les plus utilisés, l’hydroxyde d’aluminium et ou le phosphate d’aluminium, accroît à peine ou pas l’immunogénicité des vaccins contre la grippe. Cependant, il serait utile d’améliorer la force et la durée de la réponse immunitaire aux vaccins traditionnels contre la grippe. Des taux d’anticorps protecteurs ne persistent généralement pas plus d’une saison et chez les personnes âgées (≥ 65 ans), la qualité de la réponse immunitaire suscitée est moins bonne que chez les enfants et les jeunes adultes ; les taux d’anticorps atteignent un pic plus faible et chutent plus rapidement. En conséquence, le taux de protection des vaccins contre la grippe n’est pas optimal chez les personnes âgées.
Au cours des dernières années, on a constaté que les émulsions huile dans l’eau (H/E) peuvent améliorer l’immunogénicité des vaccins contre la grippe. L’adjonction d’une émulsion H/E sur base de squalène (MF59, développé par Chiron-Novartis) a un effet favorable sur l’immunogénicité des vaccins contre la grippe saisonnière.
Depuis 1997, le vaccin contre la grippe adjuvanté MF59 de Novartis est disponible en Europe et est utilisé sous la marque Fluad dans de nombreux pays européens pour la vaccination des personnes âgées (≥ 65 ans). Les études cliniques et l’expérience de la pratique durant quelques années ont montré que Fluad est sûr et bien toléré.
GSK et SanofiPasteur ont exploré l’effet d’émulsions H/E sur l’immunogénicité des vaccins contre la grippe, dans le contexte de la pression pandémique liée au virus hautement pathogène H5N1 de grippe aviaire et de la nécessité de réduire les doses d’antigènes pour la production de vaccins pandémiques.
Les résultats des études cliniques nous ont appris que ces candidats vaccins pandémiques adjuvantés étaient sûrs et immunogènes. Sur base des bons résultats observés avec un vaccin H5N1, GSK a développé le vaccin (Pandemrix) qui a été utilisé dans la lutte contre le virus H1N1pdm2009 et qui a été administré partout sur la planète à des dizaines de millions de personnes.
Modalités alternatives d’administration
L’immunogénicité d’un vaccin peut être accrue non seulement par l’ajout d’adjuvant, mais aussi par l’usage d’une voie d’administration alternative. SanofiPasteur a développé un vaccin contre la grippe pour administration par voie intradermique qui a reçu le nom commercial d’IntanzaTM et auquel une autorisation de mise sur le marché européen a été délivrée en 2009. Le contenu vaccinal (0,1 ml) est injecté à ± 1,5 mm de profondeur dans la peau au moyen d’une seringue préremplie porteuse d’une microaiguille spécialement mise au point. Cette aiguille permet un dépôt standardisé du vaccin dans le derme avec un caractère invasif minimal.
Le tableau 1 donne un aperçu de quelques vaccins contre la grippe saisonnière courants. Les vaccins sont rangés par ordre alphabétique. Certains d’entre eux ne sont pas encore disponibles sur le marché belge, mais ils sont attendus à brève échéance.
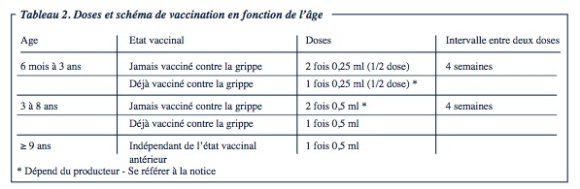
Le tableau 2 présente le dosage et le schéma de vaccination avec les différents vaccins, en fonction de l’âge de la personne vaccinée.
Protection conférée par les vaccins contre la grippe saisonnière
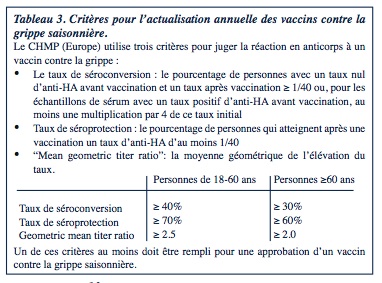
Un vaccin contre la grippe doit d’abord stimuler la production d’anticorps contre l’HA. C’est en effet le premier mécanisme qui fournit une immunité directe éliminant le virus de la grippe. Sur base d’une étude de 1972 au cours de laquelle des adultes en bonne santé étaient exposés à un virus de la grippe, un marqueur de protection, encore utilisé de nos jours (Hobson, 1972) a été défini. Dans cette étude, un taux d’inhibition de l’hémagglutination (taux anti-HA) de 1/36 semblait correspondre à une réduction de 50% de l’infection ; depuis lors un taux anti-HA ≥ 1/40 est considéré comme corrélé à une protection contre la grippe.
Des études plus récentes montrent cependant qu’un taux anti-HA ≥ 1/40 n’est pas une mesure correcte pour la protection chez l’enfant et les personnes ̂gées. Avec un taux anti-HA ≥ 1/40, seuls 22% d’un groupe d’enfants semblent être protégés contre la grippe. Un taux de 1/110 est nécessaire pour atteindre 50% de réduction de l’infection. Gravenstein et al ont montré que parmi 72 personnes âgées vaccinées avec une grippe documentée, 60% avaient, 4 semaines après la vaccination, un taux d’anti-HA ≥ 1/40 et 31% un taux d’anti-HA ≥ 1/640. Ces résultats montrent que le taux d’anti-HA n’est pas un indicateur parfait de protection contre la grippe et que d’autres éléments de la réponse immunitaire induite par la vaccination ou la maladie naturelle doivent jouer un rôle. On pense en premier lieu à l’immunité cellulaire et plus spécifiquement à l’immunité cellulaire T qui est éveillée par la vaccination ou la maladie (Schotsaert, 2012).
Selon les normes de qualité actuelles (tableau 3), les TIV (vaccins inactivés split ou sub-unit) déclenchent une réponse immunitaire adéquate chez la plupart des personnes vaccinées (enfants, adultes et personnes âgées) : avec un taux d’anti-HA ≥ 1/40, ils offrent une protection contre l’infection.
Le taux de protection (vaccine effectiveness) d’un vaccin contre la grippe saisonnière est d’autant meilleur que les souches inclues dans le vaccin correspondent aux souches de virus en circulation. Lorsque les souches vaccinales et les souches circulantes sont antigéniquement identiques, les TIV permettent d’éviter, chez des adultes en bonne santé de moins de 65 ans, 70-90% des grippes confirmées par laboratoire. Lorsque les souches diffèrent, l’efficacité des vaccins contre la grippe est réduite.
Les vaccins contre la grippe donne une moins bonne protection chez les adultes plus âgés et chez les personnes fragilisées par une morbidité importante (cardiaque, pulmonaire, diabète, etc), même en présence d’une concordance parfaite entre les souches vaccinales et circulantes.
Accroître le pouvoir protecteur
Pour accroître le pouvoir protecteur des vaccins contre la grippe, prioritairement pour ceux qui courent un risque de complications graves suite à une grippe, on se tourne vers des méthodes pour augmenter l’immunogénicité de ces vaccins.
• Les vaccins à base de virus inactivés entiers (whole inactived vaccins) sont plus immunogènes que les vaccins split ou subunit. Cette propriété repose sur la présence dans le vaccin d’un plus large spectre de protéines virales (NP, protéines de la matrice, etc) et d’ARN viral. Ces composants, qui ne sont plus présents dans les vaccins split et sub-unit, constituent des adjuvants naturels qui stimulent considérablement le système immunitaire inné et de cette manière permettent une réponse immunitaire adaptative plus forte (plus d’anticorps et de cellules T).
• Cette activation du système immunitaire inné est aussi obtenue par l’usage d’adjuvants. En ajoutant des émulsions huile/eau (MF59, AS03, AF03) aux vaccins split et sub-unit, on attire plus de granulocytes et de macrophages au site d’injection, ce qui entraîne une production accrue de signaux moléculaires (chimiotactisme) et ainsi un meilleur recrutement et une meilleure activation des cellules qui captent et présentent les antigènes vaccinaux aux lymphocytes T. Le résultat final de ce processus est d’obtenir des réponses humorale (taux d’anti-HA) et cellulaire (réactions des cellules T-helper) plus fortes.
• L’immunogénicité d’un antigène (peptide ou protéine recombinante) peut également être augmentée en le couplant à un virosome. Les virosomes sont des vésicules sphériques ayant un diamètre d’environ 150 nm, qui sont composées d’une membrane lipidique contenant les protéines membranaires d’un virus. Un type spécial de virosomes sont les immunostimulating reconstituted influenza virosomes ou IRIV. Ils contiennent l’hémagglutinine du virus Influenza et doivent leur effet adjuvant à leur structure et aux propriétés de l’hémagglutinine. D’autres protéines peuvent être liées à ces IRIVs et gagner ainsi en immunogénicité. Les vaccins humains qui utilisent la technologie du virosome (IRIV) sont les vaccins contre la grippe InflexalTM (Berna Biotech / Crucell Solvay) et contre l’hépatite A HepaxalTM (Berna Biotech / Crucell).
• La peau constitue un obstacle à la pénétration dans le corps d’agents étrangers et de micro-organismes. La peau peut ainsi être considérée comme le plus grand organe immunitaire de l’organisme. En raison de la présence d’une grande quantité de cellules spécialisées, telle les cellules de Langerhans et les macrophages, la peau est mieux équipée que la plupart des autres tissus pour détecter les antigènes et induire, via une réaction immunitaire innée plus efficace, une réponse immunitaire adaptative plus forte et pour la maintenir. La vaccination intradermique est de ce fait la voie d’accès la plus directe et la plus efficace au système immunitaire.
Des études cliniques chez des adultes de 18-60 ans et ≥ 60 ans ont montré que l’administration intradermique de 15 μg d’HA (vaccin contre la grippe saisonnière) induisait une réponse immunitaire plus forte que le produit de contrôle injecté en intramusculaire. Chez les adultes plus jeunes (18-60 ans), 9 μg d’HA induisait une réponse aussi forte que 15 μg d’HA en intramusculaire (Leroux-Roels, 2008).
• Le vaccin vivant atténué contre la grippe (live attenuated influenza vaccine, LAIV) doit son efficacité au fait qu’il provoque une infection légère, souvent sub-clinique, qui mobilise un spectre plus large de phénomènes immunologiques que les vaccins inactivés contre la grippe.
LAIV est plus efficace chez l’enfant et significativement moins chez les adultes. Cette différence est peut-être attribuable au fait que les enfants (principalement les plus jeunes) n’ont pas encore d’immunité contre le virus de la grippe, ce qui induit lors d’une exposition au LAIV une infection et en conséquence une série de réactions immunologiques, dont l’apparition d’anticorps dirigés contre l’HA. Les adultes ont habituellement déjà développé une immunité contre la grippe et disposent donc aussi bien d’anticorps contre l’HA (et d’autres composants du virus) que de lymphocytes spécifiques au virus influenza. Une instillation nasale de LAIV n’induira chez eux pas d’infection, ou une très faible infection, ce qui limitera aussi fortement la réaction immunitaire (augmentation des taux d’anti-HA).
Conclusion
Nous disposons d’une variété de formes et de formulations de vaccins contre la grippe saisonnière.
Les plus utilisés sont les vaccins inactivés split ou sub-unit (TIV). Ces vaccins sont efficaces et offrent une bonne protection chez les grands enfants et les adultes (également chez les femmes enceintes). Les TIV induisent aussi une protection chez les adultes de 65 ans et plus et les personnes fragilisées (affections chroniques du cœur, des poumons, etc ; diabète ; immunodéficience...).
Il y a cependant un besoin de vaccins plus immunogènes pour ces groupes particuliers. L’adjonction d’adjuvants (émulsion huile/eau) aux vaccins contre la grippe saisonnière ou l’administration intradermique semble améliorer la éponse à une dose standard de vaccin contre la grippe. Des études contrôlées, en double aveugle, comparant le taux de protection d’un vaccin amélioré avec le vaccin standard TIV sont nécessaires pour démontrer la supériorité du nouveau vaccin. Les vaccins vivants atténués (LAIV) semblent plutôt recommandés pour les enfants puisqu’ils induisent principalement à cette époque de la vie une bonne protection et une stimulation initiale (priming) plus large du système immunitaire que le TIV, incluant une réponse en anticorps mais également par les cellules T.
Centrum voor Vaccinologie - UGent
Références :
- Black S, Nicolay U, Vesikari T et al. Hemagglutination inhibition antibody titers as a correlate of protection for inactivated influenza vaccines in children. The Pediatric infectious disease journal, 30(12), 1081-1085 (2011).
- Gravenstein S, Drinka P, Duthie EH et al. Efficacy of an influenza hemagglutinin- diphtheria toxoid conjugate vaccine in elderly nursing home subjects during an influenza outbreak. Journal of the American Geriatrics Society, 42(3), 245-251 (1994).
- Fiore AE, Uyeki TM, Broder K, et al. Prevention and control of influenza with vaccines : recommendations of the Advisory Committee on Immunization Practices (ACIP), 2010. MMWR. Recommendations and reports 2010 ;59:1-62.
- Hobson D, Curry RL, Beare AS, Ward-Gardner A. The role of serum haemagglutination-inhibiting antibody in protection against challenge infection with influenza A2 and B viruses. The Journal of hygiene, 70(4), 767-777 (1972).
- Leroux-Roels I, Vets E, Freese R, Seiberling M, Weber F, Salamand C, Leroux-Roels G. Seasonal influenza vaccine delivered via intradermal microinjection : randomised controlles safety and immunogenicity trial in adults. Vaccine 2008 ;26:6614-6619.
- Schotsaert M, Saelens X, Leroux-Roels G. Influenza vaccines : T cell responses deserve more attention. Exp Rev Vaccines, 2012 (in press)
Rechercher
Abonnez-vous à la newsletter
 Vax Info
Vax Info Grippe : avis du CSS pour la saison 2019-2020
Grippe : avis du CSS pour la saison 2019-2020