
Griep
De zoektocht naar meer immunogene griepvaccins
De meest gebruikte griepvaccins zijn trivalente, geïnactiveerde split- of subunitvaccins. Deze vaccins bieden een degelijke bescherming bij kinderen en volwassenen. Voor oudere volwassenen (≥ 65 jaar) en kwetsbare personen (chronische zieken, diabetici, immuundeficiënte personen) is er nood aan meer immunogene vaccins. Toevoegen van adjuvantia (olie-in-water emulsie) of intradermale injectie lijkt het immuunantwoord op een standaarddosis griepvaccin te verhogen. Voor jonge kinderen bieden levend verzwakte vaccins een bredere ‘priming’ van het immuunsysteem.
De meest effectieve strategie om griep te voorkomen is jaarlijkse vaccinatie. Sinds vele jaren wordt griepvaccinatie aanbevolen voor personen met een verhoogd risico op ernstige verwikkelingen van griepinfectie. Internationaal bestaat een trend om de indicaties voor griepvaccinatie te verruimen. Zo wordt in de VSA de jaarlijkse griepvaccinatie sinds 2010 aanbevolen voor alle personen ouder dan 6 maanden [Fiore, 2010].
Antigenische variabiliteit influenzavirus
Een belangrijke en blijvende uitdaging voor de productie van griepvaccins is de antigenische variabiliteit van het influenzavirus. Om hieraan tegemoet te komen, vergaderen vertegenwoordigers van het Global Influenza Surveillance and Response System (GISRS) van de Wereldgezondheidsorganisatie (WGO) tweemaal per jaar over de samenstelling van het seizoensgriepvaccin voor het noordelijk en het zuidelijk halfrond. Op basis van de meest recente surveillancegegevens van het GISRS worden de influenzastammen geselec- teerd die in het volgend seizoens- griepvaccin zullen worden opgenomen.
In februari 2012 werd de samenstelling van het griepvaccin voor het winterseizoen 2012-2013 (noordelijk halfrond) als volgt vastgelegd: een A/ California/7/2009 (H1N1)pdm09-like virus, een A/Victoria/361/2011 (H3N2)- like virus, een B/Wisconsin/1/2010-like virus (van de B/Yamagata-lijn).
Om de productie van griepvaccins mogelijk te maken, gebeurt de selectie van de vaccinstammen doorgaans 9 tot 12 maanden voor de aanvang van het griepseizoen. In deze periode kan nog een nieuwe driftvariant opduiken, waardoor de stammen in het vaccin kunnen verschillen van de circulerende virusstammen. Deze ‘mismatch’ leidt tot een geringere effectiviteit van het vaccin.
In de 31 seizoensgriepjaren van 1980-1981 tot 2011-2012 werd de vaccinsamenstelling elf maal gewijzigd voor de influenza A/H1N1N component, negentien maal voor de A/H3N2 component en vijftien maal voor de influenza B component.
De jaarlijkse griepepidemieën bij de mens worden veroorzaakt door influenza A en B virussen. Het erfelijk materiaal van influenzavirussen omvat 8 separate RNA segmenten die coderen voor 11 eiwitten die instaan voor de structuur en de replicatie van het virus. De twee oppervlakte-eiwitten haemagglutinine (HA) en het neuraminidase (NA) zijn de belangrijkste doelwitten van de beschermende humorale immuniteit. Dieper in de mantel bevinden zich nog de matrixeiwitten M1 en M2, en rond de RNA-segmenten bevindt zich het nucleoproteïne (NP).
De influenza A virussen worden geklasseerd in subtypen op basis van de belangrijkste oppervlakte-antigenen HA en NA. Sinds 1977 circuleren bij de mens twee influenza A subtypen, A/H1N1 en A/H3N2. Van de influenza B virussen induceren twee verschillende genetische lijnen humane pathologie, met name de Yamagata- en de Victoria-lijn.
Nieuwe influenza A virusvarianten ontstaan op basis van antigenische drift en antigenische shift.
Antigenische drift is het gevolg van puntmutaties en recombinaties die optreden tijdens de virale replicatie. Dit fenomeen ligt aan de basis van de veranderingen die regelmatige herzieningen van de seizoensgriepvaccins noodzakelijk maken.
Antigenische shift is een veel ingrijpender fenomeen dat kan leiden tot grieppandemieën. Shift treedt op wanneer twee verschillende influenzavirussen eenzelfde cel infecteren en daarin hun genetisch materiaal (8 gensegmenten) herschikken (reassortment). Op deze wijze kan een humaan seizoensgriepvirus plots haemagglutinine, neuraminidase en eventueel nog andere genen van een hoogpathogeen vogelgriepvirus verwerven. Het pandemisch griepvirus van 2009 (influenza A/H1N1pdm09) bevat een combinatie van genen die werden aangetroffen bij de mens, het varken en bij vogels.
Verschillende types griepvaccins
Trivalente geïnactiveerde vaccins (TIV)
De meeste seizoensgriepvaccins zijn trivalente geïnactiveerde vaccins (trivalent inactivated vaccines, TIV). Zij bevatten 15 μg HA van elk van de influenzastammen die in het vaccin zijn opgenomen (in 2012, A/H1N1, A/H3N2 en B).
De griepvirussen die worden verwerkt in seizoensgriepvaccins worden gekweekt in geëmbryoneerde kippeneieren. Eén kippenei levert materiaal voor ongeveer 1 vaccindosis met 15μg HA van elk van de drie geselecteerde virusstammen (A/ H1N1, A/H3N2 en B).
De zaaistammen van de influenza B component worden gewoonlijk bereid op basis van veldisolaten die goed groeien in geëmbryoneerde kippeneieren. Omdat de meeste natuurlijk voorkomende influenza A stammen niet gedijen in kippeneieren, zijn ze niet meteen geschikt voor vaccinproductie. Daarom worden de RNA-segmenten die coderen voor het HA en het NA van het wild- type influenzavirus, samengebracht met de 6 overige RNA-segmenten van een laboratoriumvirusstam die wel goed groeit in kippenembryo’s (PR8 influenza A virus). De creatie van deze productiestammen gebeurt in gespecialiseerde laboratoria in het New York Medical College, het National Institute for Biological Standards and Control (NIBSC-UK) en de vaccinproducent CSL in Australia.
Griepvirussen, geïsoleerd uit kippen- eieren, worden eerst chemisch geïnactiveerd en vervolgens door een detergensbehandeling gefragmenteerd. Naargelang de graad van zuivering van de fragmenten bekomt men een splitvirusvaccin of een subunitvaccin. Het subunitvaccin is het meest zuivere product dat vrijwel uitsluitend uit HA-moleculen bestaat en een beetje NA. Het splitvaccin bevat naast HA en NA ook nog matrixeiwitten en nucleoproteine. Van split- en subunitvaccins wordt geëist dat zij per vaccindosis 15 μg HA van elk van de geselecteerde virusstammen bevatten.
Een volledig virus (whole virus) vaccin bekomt men wanneer geïnactiveerd virus intact wordt gelaten en niet wordt gefragmenteerd. Whole virus vaccins waren de eerste griepvaccins die werden gebruikt. Zij waren zeer immunogeen en effectief, maar werden omwille van hun reactogeniciteit (bijwerkingen, vooral bij kinderen) vervangen door de meer gezuiverde split- en subunitvaccins.
In sommige landen (o.m. in Rusland) worden nog whole virus vaccins geproduceerd en gebruikt. Ook in de strijd tegen pandemische griepvirussen (H5N1 en H1N1pdm09) werden whole virus vaccins ingezet.
Al deze vaccins of vaccinformaten bevatten gedood (geïnactiveerd, geheel of gefragmenteerd) griepvirus en kunnen dus zelf nooit een griepinfectie veroorzaken. In sommige gevallen induceren zij lichte koorts of spierpijn die onterecht als een griep worden beschouwd. Bovendien beschermt een griepvaccin enkel tegen griep en blijven gevaccineerde personen nog steeds vatbaar voor infectie door andere respiratoire pathogenen (rhinovirus, adenovirus, RSV, humaan metapneumovirus,...). Deze infecties worden door patiënten vaak als griep aanzien, waardoor het vertrouwen in griepvaccins onterecht vermindert.
Levend verzwakt griepvaccin (LAIV)
Een levend verzwakt griepvirusvaccin (LAIV, Live Attenuated Influenza Virus) wordt sinds 2003 in de VSA gebruikt voor vaccinatie van personen van 2 tot 49 jaar oud. Het Europese Geneesmiddelen Agentschap (EMA) heeft dit vaccin goedgekeurd voor personen van 2 tot 18 jaar. Het wordt intranasaal toegediend via een verstuivertje (spray device).
Deze levend geattenueerde virussen worden geproduceerd door elke geselecteerde virusstam (WGO-selectie) te reassorteren met een bijzondere virusstam (cold-adapted influenza A/ Ann Arbor/6/1960) die repliceert in de nasopharynx bij 25°C, maar niet bij hogere temperaturen dieper in de luchtwegen.
Dit vaccin kan in tegenstelling tot de TIV wel een lichte griepinfectie (lichte koorts, neusloop, neuscongestie en lichte keelpijn) uitlokken.
Verschillende productiemethodes
Ondanks het lange productieproces (tot 8 maanden) blijft de vaccinindustrie nog steeds overwegend op kippeneieren beroep doen. Sinds enige tijd worden griepvirussen ook geproduceerd in celcultuur. Het bedrijf dat hierin het verst is gevorderd is Baxter, maar ook andere producenten (zoals Novartis, SanofiPasteur MSD, GSK,... ) exploreren deze technologie.
Voordelen van de productie in celcultuur zijn: de onafhankelijkheid van de voorraad en de productie van bevruchte kippeneieren, de mogelijkheid om direct wild-type virussen te gebruiken in plaats van reassortanten die op eieren groeien, geringere kans op microbiële contaminatie, inkorten van het productieproces met ± 10 weken, geen kans meer op allergie tegenover kippeneieren.
Adjuvantia
Aan seizoensgriepvaccins worden doorgaans geen adjuvantia toegevoegd omdat de meest gebruikte adjuvantia, aluminiumhydroxide of aluminiumfosfaat, de immunogeniciteit van griepvaccins niet of nauwelijks verhogen. Nochtans zou het nuttig zijn om de sterkte en de duur van de immuunreactie opgewekt door traditionele griepvaccins te verbeteren.
Beschermende antilichaamspiegels blijven meestal niet langer dan één seizoen aanwezig. Bij oudere personen (≥65 jaar) is de kwaliteit van het geïnduceerde immuunantwoord bovendien minder goed dan bij kinderen of jonge volwassenen; de antilichaamtiters bereiken minder hoge piekwaarden en dalen sneller. Daardoor is de beschermingsgraad van griepvaccins bij ouderen niet optimaal.
In de voorbije jaren is gebleken dat olie-in-water (O/W) emulsies de immunogeniciteit van griepvaccins kunnen verbeteren. Toevoeging van een O/W emulsie op basis van squaleen (MF59, ontwikkeld door Chiron-Novartis) heeft een gunstig effect op de immunogeniciteit van seizoensgriepvaccins. Sinds 1997 is het MF59-geadjuvanteerde griepvaccin van Novartis beschikbaar in Europa (Fluad) en wordt het in tal van Europese landen gebruikt voor de vaccinatie van oudere volwassenen (≥ 65 jaar). Klinische studies en jarenlange praktijkervaring tonen dat Fluad veilig is en goed wordt getolereerd.
Omwille van de pandemische dreiging van het hoogpathogene H5N1 vogelgriepvirus en met het oog op een dosisreductie bij de productie van pandemische vaccins, exploreerden GSK en Sanofipasteur het effect van O/W emulsies op de immunogeniciteit van griepvaccins. De resultaten van de klinische studies toonden aan dat deze geadjuvanteerde kandidaat pandemische vaccins veilig en immunogeen waren. Op basis van de goede resultaten die werden bekomen met een H5N1-vaccin, ontwikkelde GSK het vaccin Pandemrix dat werd ingezet in de strijd tegen het H1N1pdm2009 virus en dat wereldwijd aan tientallen miljoenen personen werd toegediend.

Alternatieve toedieningswegen
Niet alleen door toevoeging van adjuvantia, maar ook door het gebruik van een alternatieve toedieningsweg kan de immunogeniciteit van een vaccin worden verhoogd.
Sanofipasteur ontwikkelde een griepvaccin voor intradermale toediening (IntanzaTM). Het verkreeg in 2009 een Europese goedkeuring (marketing authorisation). De entstof (0,1 ml) wordt ± 1,5 mm diep in de huid ingespoten met een voorgevulde spuit die is uitgerust met een speciaal ontwikkelde micronaald. Deze micronaald zorgt voor een minimaal invasief karakter en een gestandaardiseerde depositie van de entstof in de dermis.

Bescherming door seizoensgriepvaccins
Een griepvaccin moet in de eerste plaats antilichamen tegen het HA opwekken. Dit is immers het enige mechanisme dat zorgt voor een directe en sterilizerende immuniteit tegen het griepvirus.
Op basis van een studie uit 1972 waarin gezonde volwassenen werden blootgesteld aan infectieus griepvirus, werd een merker voor bescherming gedefiniëerd die tot vandaag wordt gebruikt (Hobson, 1972). Omdat in deze studie een hemagglutinatie-inhibitietiter (HAI-titer) van 1/36 bleek overeen te komen met 50% reductie van de infectie, wordt sindsdien een HAI-titer van ≥ 1/40 beschouwd als een correlaat voor bescherming tegen griepinfectie.
Recente studies tonen evenwel aan dat een HAI-titer van 1/40 geen correcte maat is voor bescherming bij kinderen en oudere personen. Met een HAI- titer van 1/40 bleken slechts 22% van een groep kinderen beschermd te zijn tegen griepinfectie. Om 50 % reductie van infectie te bekomen was een titer van 1/110 nodig. Gravenstein en medewerkers stelden vast dat van 72 gevaccineerde oudere personen met een gedocumenteerde griepinfectie, 60% HAI-titers had van ≥ 1/40 en 31% HAI-titers van ≥1/640 vier weken na vaccinatie.
Deze vaststellingen tonen aan dat de HAI-titer geen perfecte maat is voor
de bescherming tegen griepinfectie en dat andere elementen van het immuunantwoord geïnduceerd door vaccinatie of natuurlijke ziekte een rol moeten spelen. In de eerste plaats wordt hierbij gedacht aan het cellulair immuunantwoord en meer bepaald de T- cel immuniteit die wordt opgewekt door vaccinatie of ziekte (Schotsaert, 2012).
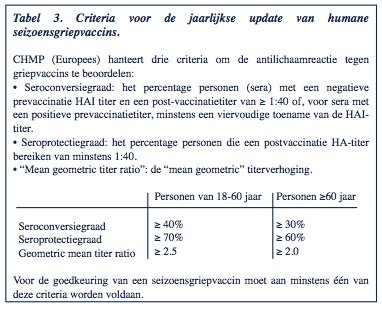
Volgens de huidige kwaliteitsnorm (Tabel 3) induceren TIV (geïnactiveerde split of subunit griepvaccins) een adequaat immuunantwoord bij de meeste gevaccineerde personen (kinderen, volwassenen en ouderen): met een HAI- titer ≥ 1/40 bieden zij bescherming tegen infectie.
De beschermingsgraad (vaccine effectiveness) van een seizoensgriepvaccin is des te beter naarmate de virusstammen die zijn opgenomen in het vaccin overeenkomen met de circulerende virusstammen. Wanneer vaccinstammen en circulerende stammen antigenisch identiek zijn, voorkomen TIV 70-90% van de laboratorium-geconfirmeerde influenzaziekten bij gezonde vol- wassenen beneden 65 jaar. Wanneer vaccinstammen en circulerende stammen verschillen, ligt de doeltreffendheid van griepvaccins lager. Bij oudere volwassenen en bij personen met belangrijke morbiditeit (cardiaal, pulmonair, diabetes enz.) bieden griepvaccins een minder goede bescherming, zelfs bij een perfecte match tussen vaccin- en circulerende stammen.
Verhogen beschermend vermogen
Om het beschermend vermogen van vaccins te verhogen, bij uitstek voor diegenen die het grootste risico lopen op ernstige verwikkelingen van een griepinfectie, wordt gezocht naar methoden om de immunogeniciteit van griepvaccins te verhogen.
• Vaccins op basis van volledig geïnactiveerd griepvirus (whole inactivated virus) zijn meer immunogeen dan split- of subunitvaccins. Deze eigenschap berust op de aanwezigheid in het vaccin van een breder spectrum aan virale eiwitten (NP, matrixeiwitten, enz.) en viraal RNA. Deze componenten, die niet langer aanwezig zijn in split- en subunitvaccins, zijn endogene adjuvantia die het aangeboren immuunsysteem flink stimuleren en daardoor zorgen voor een sterker adaptief immuunantwoord (meer antistoffen en T-cellen).
• Deze activatie van het aangeboren immuunsysteem wordt ook bekomen door het gebruik van adjuvantia. Door olie-in-water emulsies (MF59, AS03, AF03) aan split- of subunitvaccins toe te voegen, worden meer granulocyten en macrofagen naar de injectieplaats getrokken en worden daar meer signaalmoleculen geproduceerd. Dat zorgt voor een betere recrutering en activering van cellen die de vaccin-antigenen opnemen en presenteren aan T-lymfocyten. Het eindresultaat van dit proces is een sterker humoraal (HAI- titers) en cellulair immuunantwoord (helper T-cel reacties).
• De immunogeniciteit van een antigen (peptide of recombinant eiwit) kan ook worden verhoogd door het te koppelen aan een virosoom. Virosomen zijn sferische vesikels met een diameter van ongeveer 150 nm die zijn opgebouwd uit een lipidenmembraan met daarin de membraaneiwitten van een virus. Een bijzonder type van virosomen zijn de immunostimulating reconstituted influenza virosomes of IRIV. Deze bevatten het hemagglutinine van influenza en danken hun adjuvant effect aan hun partikelstructuur en de eigenschappen van het hemagglutinine. Andere eiwitten kunnen aan deze IRIVs worden gekoppeld en winnen daardoor aan immunogeniciteit. Humane vaccins die gebruik maken van de virosoomtechnologie (IRIV) zijn het influenzavaccin Inflexal (Berna Biotech/ Crucell Solvay) en het hepatitis A vaccin Hepaxal (Berna Biotech/Crucell).
• De huid vormt een eerstelijnsbarrière tegen het binnendringen van vreemde agentia en micro-organismen. De huid kan worden beschouwd als het grootste immuunorgaan van het lichaam. Door de aanwezigheid van grote aantallen gespecialiseerde cellen, Langerhanscellen en macrofagen, is de huid beter uitgerust dan de meeste andere weefsels om antigenen op te sporen en via een efficiënter aangeboren immuunreactie ook een sterker adaptief immuunantwoord te induceren en te onderhouden. Intradermale vaccinatie is daarom de meest directe en efficiëntste toegangsweg tot het immuunsysteem.
Klinische studies bij volwassenen van 18-60 jaar en ≥ 60 jaar hebben aangetoond dat intradermale toediening van 15 μg HA (seizoensgriepvaccin) een sterker immuunantwoord induceert dan het controleproduct dat intramusculair werd toegediend. Bij volwassen (18-60 jaar) induceerde 9 μg HA intradermaal een even sterk immuunantwoord als 15 μg intramusculair (Leroux-Roels, 2008).
• Het levend verzwakt griepvirusvaccin (live attenuated influenza vaccine of LAIV) dankt zijn doeltreffendheid aan het feit dat het een milde, dikwijls subklinische infectie induceert die een breder scala aan immunologische fenomenen uitlokt dan geïnactiveerde griepvaccins.
LAIV is het efficiëntst bij kinderen en beduidend minder bij volwassenen. Dit verschil is wellicht toe te schrijven aan het feit dat (vooral jonge) kinderen nog geen immuniteit hebben tegen het griepvirus, waardoor een blootstelling aan het LAIV een infectie induceert en als gevolg daarvan een reeks immunologische reacties op gang brengt, waaronder de inductie van antistoffen gericht tegen HA. Volwassenen hebben doorgaans reeds een immuniteit tegen griep ontwikkeld en beschikken daardoor over zowel antistoffen tegen HA (en andere componenten van het virus) als over influenza-specifieke T-lymfocyten. Een nasale instillatie van LAIV zal bij hen geen of slechts een bijzonder zwakke infectie induceren, waardoor ook de immuunreactie (HAI-titerverhoging) zeer beperkt is.
Besluit
Er bestaan verschillende formaten en formuleringen van seizoensgriepvaccins.
De meest gebruikte griepvaccins zijn trivalente, geïnactiveerde split- of subunitvaccins. Deze vaccins bieden een degelijke bescherming bij kinderen en volwassenen (ook zwangere vrouwen). Ook aan oudere volwassenen (≥ 65 jaar) en kwetsbare personen (chronische zieken, diabetici, immuundeficiënte personen) bieden TIV bescherming tegen griepinfectie.
Voor deze bijzondere groepen is er echter nood aan meer immunogene vaccins. Toevoegen van adjuvantia (olie-in-water emulsie) aan griepvaccins of intradermale injectie lijkt het immuunantwoord op een standaarddosis griepvaccin te verhogen. Gecontroleerde, dubbelblinde studies die de beschermingsgraad van een verbeterd vaccin vergelijken met dat van het standaard (TIV) vaccin, zijn nodig om de superioriteit van het nieuwe product aan te tonen. LAIV lijken eerder aanbevolen voor kinderen omdat zij vooral in deze leeftijdsgroep een goede bescherming induceren en een bredere “priming” van het immuunsysteem (niet alleen antistoffen maar ook een T-cel antwoord) dan TIV.
Centrum voor Vaccinologie - UGent
Referenties
- Black S, Nicolay U, Vesikari T et al. Hemagglutination inhibition antibody titers as a correlate of protection for inactivated influenza vaccines in children. The Pediatric infectious disease journal, 30(12), 1081-1085 (2011).
- Gravenstein S, Drinka P, Duthie EH et al. Efficacy of an influenza hemagglutinin- diphtheria toxoid conjugate vaccine in elderly nursing home subjects during an influenza outbreak. Journal of the American Geriatrics Society, 42(3), 245-251 (1994).
- Fiore AE, Uyeki TM, Broder K, et al. Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2010. MMWR. Recommendations and reports 2010;59:1-62.
- Hobson D, Curry RL, Beare AS, Ward-Gardner A. The role of serum haemagglutination-inhibiting antibody in protection against challenge infection with influenza A2 and B viruses. The Journal of hygiene, 70(4), 767-777 (1972).
- Leroux-Roels I, Vets E, Freese R, Seiberling M, Weber F, Salamand C, Leroux-Roels G. Seasonal influenza vaccine delivered via intradermal microinjection: randomised controlles safety and immunogenicity trial in adults. Vaccine 2008;26:6614-6619.
- Schotsaert M, Saelens X, Leroux-Roels G. Influenza vaccines: T cell responses deserve more attention. Exp Rev Vaccines, 2012 (in press)
 Griep / Advies Hoge Gezondheidsraad voor winterseizoen 2019-2020
Griep / Advies Hoge Gezondheidsraad voor winterseizoen 2019-2020
 Effectiviteit van herhaalde jaarlijkse griepvaccinatie
Effectiviteit van herhaalde jaarlijkse griepvaccinatie
 Seizoensgriep: nieuwe aanbevelingen vaccinatie 2018-2019
Seizoensgriep: nieuwe aanbevelingen vaccinatie 2018-2019
 Seizoensgriep 2017 - 2018: adviezen van de HGR en BCFI
Seizoensgriep 2017 - 2018: adviezen van de HGR en BCFI
 Doeltreffendheid en werkzaamheid van influenzavaccinatie
Doeltreffendheid en werkzaamheid van influenzavaccinatie
Artikelen over hetzelfde thema
Artikelen
 Griep / Advies Hoge Gezondheidsraad voor winterseizoen 2019-2020
Griep / Advies Hoge Gezondheidsraad voor winterseizoen 2019-2020
 Effectiviteit van herhaalde jaarlijkse griepvaccinatie
Effectiviteit van herhaalde jaarlijkse griepvaccinatie
 Seizoensgriep: nieuwe aanbevelingen vaccinatie 2018-2019
Seizoensgriep: nieuwe aanbevelingen vaccinatie 2018-2019
 Seizoensgriep 2017 - 2018: adviezen van de HGR en BCFI
Seizoensgriep 2017 - 2018: adviezen van de HGR en BCFI
 Doeltreffendheid en werkzaamheid van influenzavaccinatie
Doeltreffendheid en werkzaamheid van influenzavaccinatie
Artikelen over hetzelfde thema
Zoeken
Abonneer u op de nieuwsbrief
 Vax Info
Vax Info